Jednostavni aromatični prsten
Jednostavni aromatični prsteni (jednostavni areni, jednostavni aromatici) su aromatična organska jedinjenja koja se sastoje samo od konjugovanih planarnih prstenastih sistema sa delokalizovanim pi elektronskim oblakom. Mnogi jednostavni aromatični prsteni imaju trivijalna imena. Oni su nalaze kao podstrukture kompleksnijih molekula (supstituisani aromatici). Tipična jednostavna aromatična jedinjenja su benzen, indol, i ciklotetradekaheptan.[1][2][3]
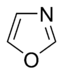
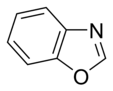
Jednostavni aromatični prsteni mogu da budu heterociklični ako sadrže neugljenične atome, npr, kiseonik, azot, ili sumpor. Oni mogu da budu monociklični kao benzen, biciklični kao naftalen, ili policiklični kao antracen. Jednostavni monociklični aromatični prsteni su obični petočlani prsteni poput pirola ili šestočlani poput piridina. Kondenzovani aromatični prsteni se sastoje od monocikličnih prstena koji dele spojne veze.
| |||||||||||||||||||||||||||||||||||||||||||||||||
Aromatični prstenovi koji sadrže azot se mogu podeliti u bazne aromatične prstenove koji se lako protonuju, i formiraju aromatične katjone i soli (npr., piridinjium), i nebazne aromatične prstene.
- U baznim aromatičnim prstenovima, slobodni par elektrona nije deo aromatičnog sistema i pruža se u ravni prstena. Taj slobodni par je odgovoran za baznost tih azotnih baza, slično azotnom atomu amina. U tim jedinjenjima atom azota nije vezan za atom vodonika. Primeri baznih aromatičnih prstena au piridin i hinolin. Nekoliko prstena sadrži bazne kao i nebazne atome azota, npr., imidazol i purin.
- U nebaznim prstenovima, slobodni elektronski par azota je delokalizovan i doprinosi aromatičnom pi elektronskom sistemu. U tim jedinjenjima, azot je vezan za atom vodonika. Primeri nebaznih aromatičnih prstena sa azotom su pirol i indol.
U aromatičnim prstenovima sa kiseonikom i sumporom, jedan od elektronskih parova heteroatoma doprinosi aromatičnom sistemu (slično nebaznim prstenovima sa azotom), dok se drugi slobodni par pruža u ravni prstena (slično baznim azotnim prstenovima).
- Molekul mora da bude cikličan.
- Svaki atom prstena mora da ima p orbitalu, koja se preklapa sa drugim p orbitalama na obe strane (koja je kompletno konjugovana).
- Molekul mora da bude planaran.
- On mora da sadrži paran broj pi elektrona; mora da zadovolji Hukelovo pravilo: (4n+2) pi electrona, gde je n ceo broj koje počinje od nule.
U kontrastu s tim, molekuli sa 4n pi elektrona su antiaromatični.
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- ↑ Katritzky A.R., Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry. Academic Press. ISBN 0080429882.
- ↑ Eicher, T.; Hauptmann, S. (2nd ed. 2003). The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications. Wiley-VCH. ISBN 3527307206.